3月1日,我校生命科学研究院李希教授及王蜀金副研究员联合汕头大学、荷兰-马斯特里赫特大学在心血管领域的国际权威期刊《Circulation Research》在线发表题为“Glycolysis-Mediated Activation of v-ATPase by Nicotinamide Mononucleotide Ameliorates Lipid-Induced Cardiomyopathy by Repressing the CD36-TLR4 Axis”的研究论文。

心血管并发症是导致糖尿病患者死亡的主要原因(占50-80%的总糖尿病患者),其中糖尿病性心肌病又是糖尿病心血管并发症的重要组成部分。心肌内蓄积过量的脂质及高脂诱发的胰岛素抵抗是触发糖尿病性心肌病的主要诱因。研究证实,CD36(scavenger receptor B2)是促进心肌摄取脂质的主要膜蛋白,且被认为是心脏脂质代谢的关键靶标。在糖尿病性心肌病中,CD36不仅参与脂质摄取,也和炎症受体TLR-4相互作用,进一步导致脂质诱导的心功能障碍。一直以来,王蜀金博士与荷兰马斯特里赫特大学-Joost J.F.P. Luiken教授长期致力于寻求“抑制CD36在胞内体-细胞膜之间易位”的策略。近年来,该团队发现心肌内CD36易位与V-ATPase介导的胞内体(endosome)酸化密切相关,且证实V-ATPase失活是在CD36介导的脂代谢失常中起着重要调节作用。
王蜀金博士回国后加入开云手机入口官网·中国有限责任公司-李希教授团队,与其一起继续专注于探究“靶向V-ATPase是否可成为逆转高脂诱导的胰岛素抵抗及保护心功能的有效策略”。在此基础上,该研究团队筛选出的一种复合型氨基酸通过调控“V-ATPase介导的溶酶体pH稳态”可逆转高脂诱导的心功能障碍。同时,该研究团队也结合烟酰胺单核苷酸(NMN)参与V-ATPase激活的提示,开展了分别补充两种营养素(氨基酸和NMN)的体内外实验,且发现:“激活的V-ATPase”可通过胞内体酸化抑制CD36/TLR4在胞膜上的分布,从而减少甘油二酯DAG的含量以及阻断TLR4介导的炎症信号通路,最终改善高脂诱导的心功能障碍。
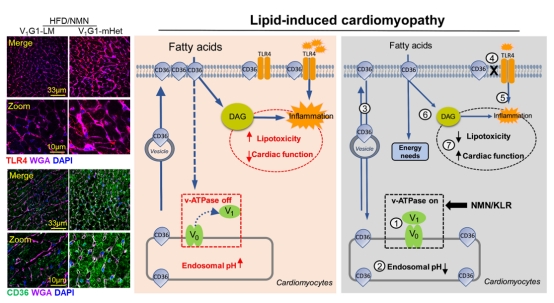
该研究论文清晰阐述了V-ATPase在糖尿病性心肌病发生与发展中的作用及机制,且提示“靶向V-ATPase”是改善肥胖/糖尿病等相关代谢性疾病的新思路。该项目得到了国家自然科学基金、重庆自然科学基金及开云手机入口官网·中国有限责任公司-未来医学青年创新团队等项目资助。该项研究由开云手机入口官网·中国有限责任公司-生科院与国内外多家单位联合展开,我校生科院-李希教授及王蜀金副研究员、汕头大学-卢玺峰教授及荷兰马斯特里赫特大学-Joost J.F.P. Luiken教授为该论文共同通讯作者。此外,我校生命科学研究院-硕士韩银莹及侯梦倩、儿童医院刘锐敏博士(现工作单位为北京安贞医院)为论文并列第一作者。
全文链接:https://doi.org/10.1161/CIRCRESAHA.123.322910。