近日,我校检验医学院谢国明教授与附属第一医院分子检测中心王力博士合作,在ACS Nano期刊上在线发表题目为“Modified Unit-Mediated Strand Displacement Reactions for Direct Detection of Single Nucleotide Variants in Active Double-Stranded DNA”的研究成果。

基因序列中的单核苷酸变异(SNV)是多种癌症发生、发展和诊断的关键驱动因素,也是精准医学的重要标志物。在该团队前期的研究工作中,他们发现基于双链链置换的策略,可以最小化环境中其他核酸的干扰,并且可以同时识别正义链和反义链上形成的错配气泡。然而,PCR产物通常是双链 DNA并且处于非活性状态,不能直接与探针杂交。因此,最大限度地保存临床样本中的信息完整性并实现双链DNA 中突变的直接检测具有重要的意义。
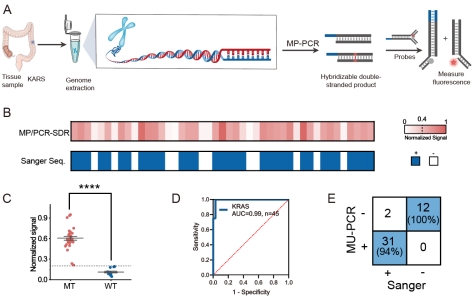
由此,该研究提出了两种获得活性双链的方法:阻碍基团(间隔子(C3)、二硫键 (S-S) 和 RNA)介导的PCR和可裂解单元(脱氧尿苷(dU)和切口酶序列)介导的PCR,并将其直接用于SNV的检测。研究团队首先在toehold和分支迁移区域之间引入了C3和SS等阻碍基团,或者用RNA替换toehold区域的DNA。研究发现,阻碍基团对于双链链置换的影响较大,尤其是二硫键,但对于单链链置换的影响较小。通过实验验证,发现双链链置换反应对于突变的鉴别能力具有优越的特异性,且不受突变位置和温度的影响。对于可切割单元,研究团队选择了UDG和Nickase进行概念验证。同样地,也测试了它们在不同温度下的对三种不同位置突变的特异性。与阻碍基团介导的SDR类似,在不同温度和突变类型下,dsSDR的特异性比ssSDR的特异性更佳。
更重要的是,该策略在质粒样本和临床结直肠癌组织样本中展现了高度可行性和潜在适用性。对来自开云手机入口官网·中国有限责任公司附属第一医院的结直肠癌组织样本进行MU-PCR和dsSDR分析。在45个肿瘤组织样本中识别出31个KRAS阳性病例和14个阴性病例。受试者工作特征(ROC)曲线下面积(AUC)为0.99。以上结果充分验证了该检测新方法具有广泛的应用前景,尤其在个性化医疗和疾病诊断中。
余红艳博士、韩小乐硕士和王蔚韬硕士为本研究共同第一作者,谢国明教授与王力博士为本文共同通讯作者。该研究得到了国家重点研发计划项目、国家自然科学基金项目、开云手机入口官网·中国有限责任公司研究生拔尖人才培育项目和重庆博士后科学基金项目的资助。
原文链接:https://pubs.acs.org/doi/10.1021/acsnano.4c01511